参考资料
第一章 化学反应的热效应 3
第一节 反应热 4
体系(system)、环境(surrounding)、反应热(heat of reaction)
焓 、焓变
热化学方程式(thermochemical equation)
\ce{H2(g) + Cl2(g) = 2HCl(g) \ \ \ \Delta $H$=-184.6 kJ/mol}
书写热化学方程式注意点:
- 需注明反应时的温度和压强;
- 需注明反应物和生成物的聚集状态;
- 各物质前的化学计量数可以是整数,也可以是分数 燃烧热(heat of combustion) \ce{H2(g) + \frac{1}{2}O2(g) = H2O(l)\ \ \ \Delta $H$ =-285.8 kJ/mol}
第二节 反应热的计算 14
盖斯定律(Hess law)
一个化学反应,不管是一步完成的还是分几步完成的,其反应热是相同的。
第二章 化学反应速率与化学平衡 23
第一节 化学反应速率 24
化学反应速率(chemical reaction rate) 对于一个化学反应:,可用任一种物质的物质的量浓度随时间的变化来表示该化学反应的速率。
影响化学反应速率的因素
基元反应(elementary reaction),自由基,反应历程,反应机理
有效碰撞(effective collision),活化分子(activated molecule),活化能(activation energy)
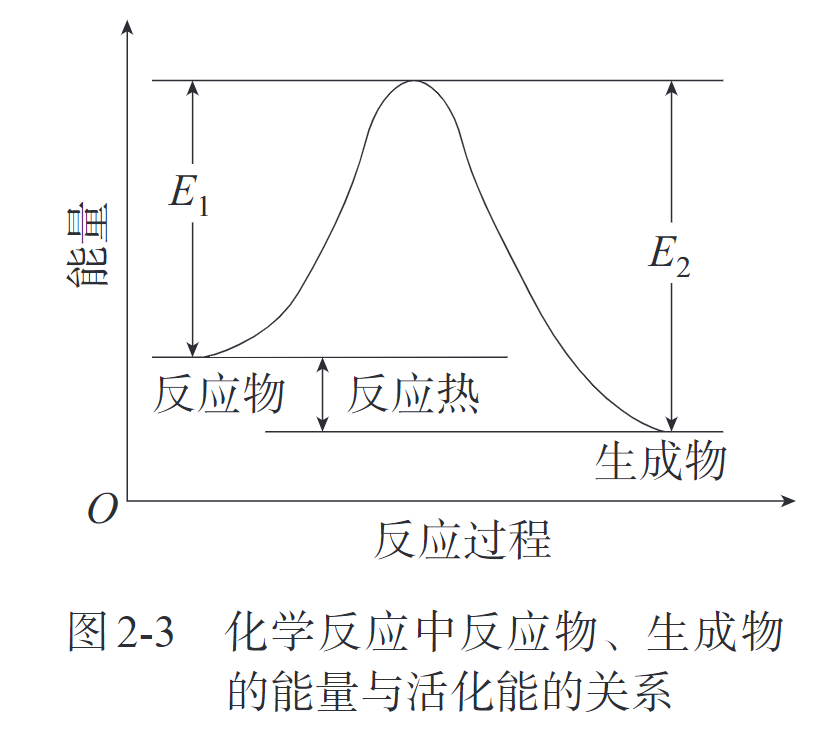
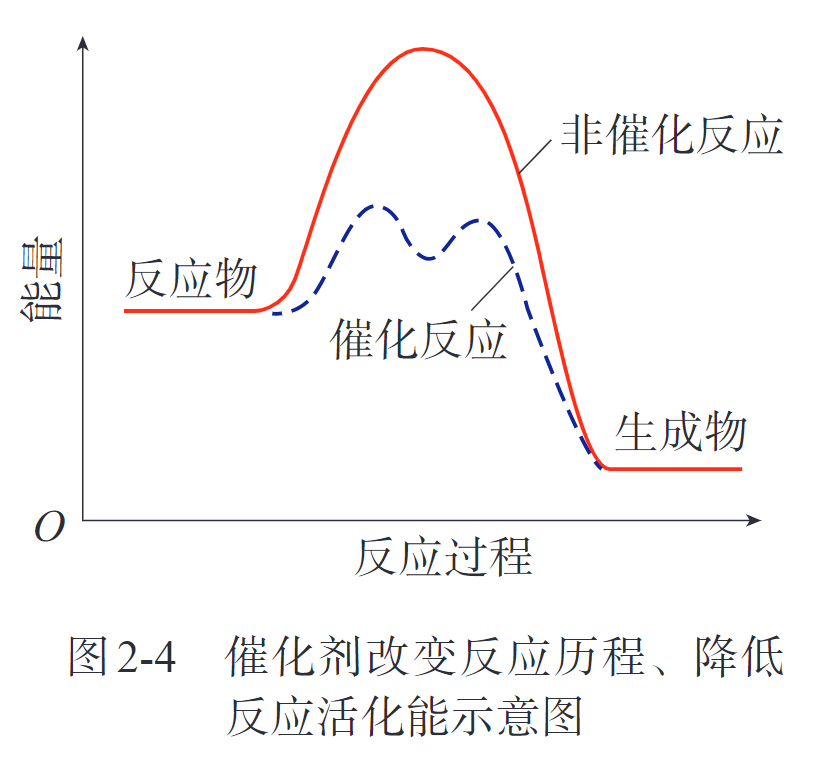 向反应体系输入能量,都有可能改变化学反应速率。
向反应体系输入能量,都有可能改变化学反应速率。
第二节 化学平衡 32
可逆反应(reversible reaction),化学平衡(chemical equilibrium)
对于一般的可逆反应: 在任意时刻的浓度商: 当该反应在一定温度下达到化学平衡时,有化学平衡常数(chemical equilibrium constant): 影响化学平衡的因素 化学平衡的移动
勒夏特列原理(Le Chatelier principle)
如果改变影响平衡的一个因素(如温度、压强及参加反应的物质的浓度),平衡就向着能够减弱这种改变的方向移动。
第三节 化学反应的方向 43
熵(entropy,符号为 ),熵增(),熵变 P45 自由能与化学反应的方向
第四节 化学反应的调控 46
举例:工业合成氨
实验活动 1 探究影响化学平衡移动的因素 55
第三章 水溶液中的离子反应与平衡 57
提示:本章的所有内容一定要结合实例去理解,掌握 P88 表格
第一节 电离平衡 58
强电解质(strong electrolyte),弱电解质(weak electrolyte)
电离平衡(ionization equilibrium)
电离常数(ionization constant) 多元弱酸,多远弱碱
第二节 水的电离和溶液的 pH 63
水的离子积常数,简称水的离子积(ionic product of water)
常温下
pH 与 的关系
\ce{pH=-\lg $c$(H+)}
酸碱中和滴定(neutralization titration)
第三节 盐类的水解 71
水解(hydrolysis)
电解质溶液中的电荷守恒与元素守恒
影响盐类水解的主要因素
盐的水解常数
第四节 沉淀溶解平衡 79
溶度积常数 (简称 溶度积 solubility product)
沉淀溶解平衡的应用
实验活动 2 强酸与强碱的中和滴定 91
实验活动 3 盐类水解的应用 94
第四章 化学反应与电能 95
第一节 原电池 96
原电池(primary battery),
化学电源(chemical power source) 一次电池(干电池 dry battery),锌锰干电池
二次电池(可充电电池,蓄电池 accumulator),铅酸蓄电池
锂离子电池 燃料电池(fuel cell),氢氧燃料电池
第二节 电解池 104
原电池是把化学能直接转化为电能的装置,电解池则是把电能直接转化为化学能的装置。
电解(electrolysis),电解池(也称电解槽 electrolytic cell)
电解原理的应用 氯碱工业
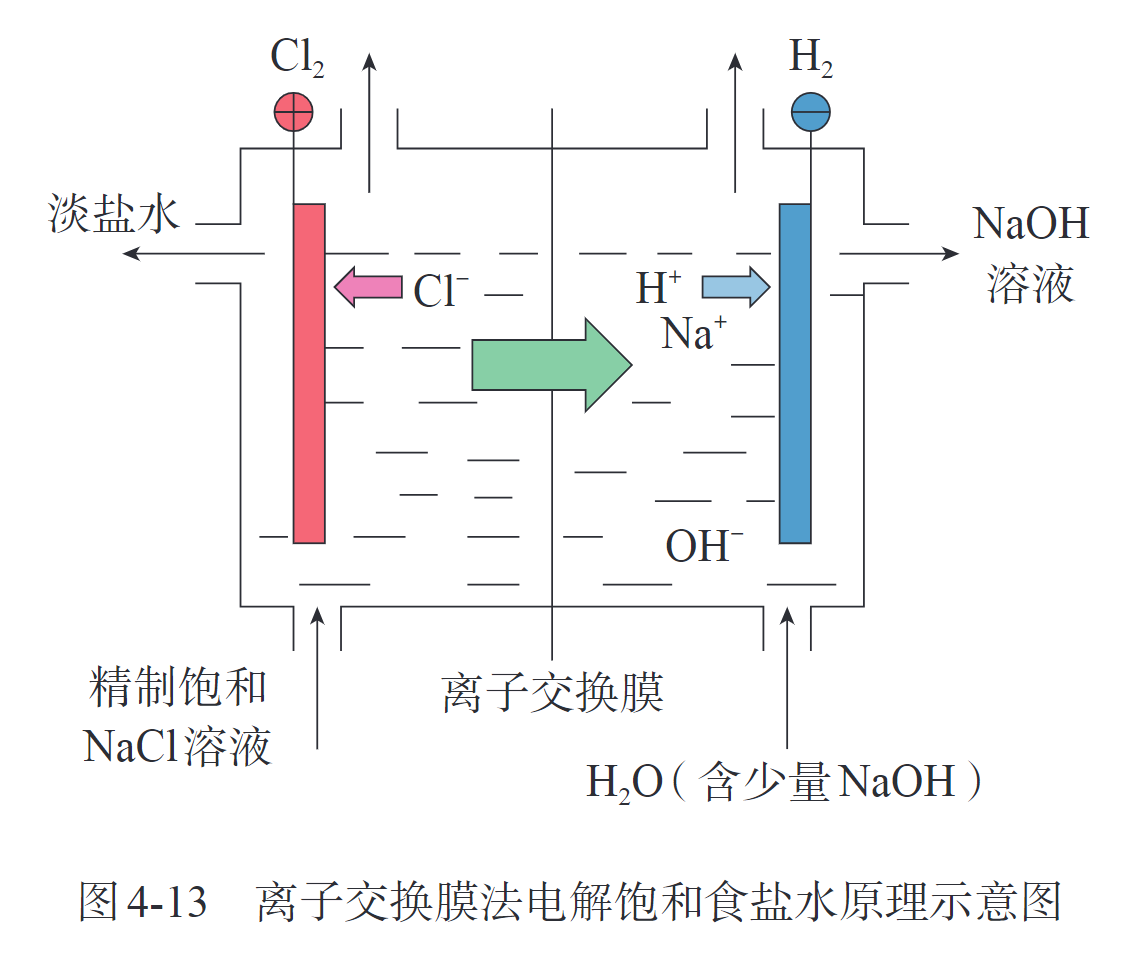 电镀(electroplating),电解精炼
电冶金(electrometallurgy)
电解熔融氯化钠
电镀(electroplating),电解精炼
电冶金(electrometallurgy)
电解熔融氯化钠
电有机合成
第三节 金属的腐蚀与防护 111
化学腐蚀(chemical corrosion),电化学腐蚀(electrochemical corrosion)
析氢腐蚀&吸氧腐蚀
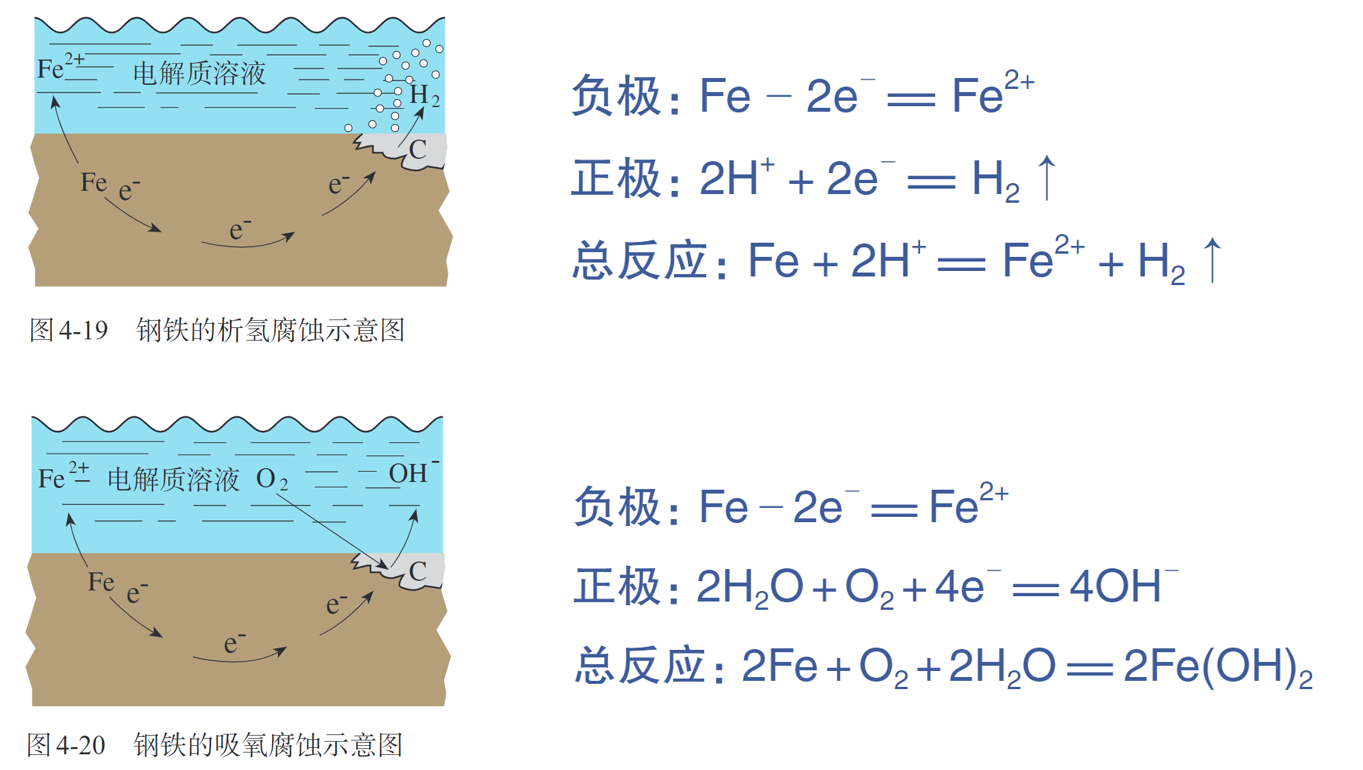
金属的防护:合金,保护层,电化学保护法,牺牲阳极法,外加电流法
实验活动 4 简单的电镀实验 122
实验活动 5 制作简单的燃料电池 123