参考资料
第一章 原子结构与性质 5
第一节 原子结构 6
原子结构(atomic structure),电子(electron),能量(energy),能层(shell),能级(level)
光谱(spectrum),光谱分析(spectrum analysis)
基态原子,原子光谱
构造原理(aufbau principle),电子排布(electronic configuration),电子排布式
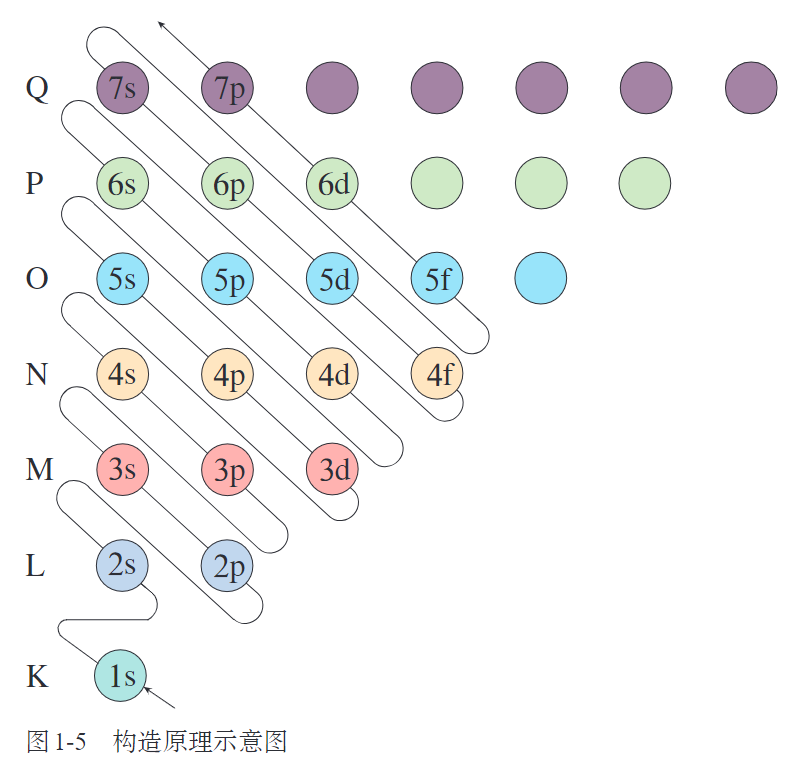
能级交错 概率(probability),概率密度(probability density),电子云(electron cloud) 原子轨道,原子轨道的形状和取向
泡利原理(Pauli exclusion principle)
在一个原子轨道里,最多只能容纳 2 个电子,它们的自旋相反
电子排布的轨道表示式(电子排布图)
洪特规则(Hund rule)
基态原子中,填入简并轨道的电子总是先单独分占,且自旋平行
能量最低原理
第二节 原子结构与元素的性质 18
元素周期系(periodic system of elements),元素周期表(periodic table of elements)
元素周期律
电离能(ionization energy),第一电离能
键合电子,电负性(electronegativity)
第二章 分子结构与性质 33
第一节 共价键 34
共价键(covalent bond),共用电子对(hared electron pair),饱和性,σ 键(σ bond),轴对称,π 键(π bond),镜面对称
键参数(bond parameters),键能(bond energy),键长(bond length),键角(bond angle)
第二节 分子的空间结构 41
测定分子结构的仪器和方法
分子的空间结构模型
价层电子对互斥模型(VSEPR model)
中心原子上的孤电子对数= 式中 a 为中心原子的价电子数(对于主族元素等于原子的最外层电子数);x 为与中心原子结合的原子数;b 为与中心原子结合的原子最多能接受的电子数
杂化轨道(hybrid orbital)理论
第三节 分子结构与物质的性质 52
极性分子(polar molecule),非极性分子(nonpolar molecule),极性键,非极性键
范德华力(van der Waals force),分子间作用力(intermolecular force)
氢键(hydrogen bond)
相似相溶(like dissolves like)
手性(chirality),手性异构体(对映异构体),手性分子
第三章 晶体结构与性质 67
晶体可简单地分为分子晶体、共价晶体、金属晶体和离子晶体四种类型
第一节 物质的聚集状态与晶体的常识 68
晶态,非晶态,塑晶态,液晶态,等离子体
晶体的自范性,各向异性
晶胞(unit cell),准晶
晶体结构的测定
第二节 分子晶体与共价晶体 78
分子晶体(molecular crystal),共价晶体(covalent crystal),金刚石(diamond)
摩氏硬度
第三节 金属晶体与离子晶体 86
金属键,金属晶体,“电子气理论”,能带理论
离子晶体(ionic crystal)
过渡晶体,混合型晶体
第四节 配合物与超分子 95
配位键,配位化合物(配合物 coordination compound)
超分子(supramolecule)
实验活动 简单配合物的形成 104